ชื่อโครงการวิจัย : กำหนดเวลาเชิงกลยุทธ์ในการรักษาด้วยยาต้านไวรัสเอชไอวี(สตาร์ท) เครือข่าย โครงการวิจัยระหว่างประเทศ เพื่อการคิดริเริ่มเชิงกลยุทธ์ ในการทดลองเกี่ยวกับเอชไอวีทั่วโลก (อินไซด์)
Study name : Strategic Timing of AntiRetroviral Treatment (START) A Multicenter Study of the International Network for Strategic Initiatives in Global HIV Trials (INSIGHT)
เครือข่ายวิจัย (รหัสโครงการ) : START
Research network (Code) :
หัวหน้าโครงการวิจัย : ศ.นพ. ขวัญชัย ศุภรัตน์ภิญโญ
Principle investigator : Professor Khuanchai Supparatpinyo, MD
หัวหน้าโครงการวิจัยร่วม : พญ. พัชรพรรณ สุคนธเวศ
Co-PI : Dr. Patcharaphan Sugandhavesa
หน่วยงานที่ร่วมวิจัย : – The University of Minnesota, Minneapolis, Minnesota, USA
(Collaborators )
- เครือข่ายโครงการวิจัยระหว่างประเทศ เพื่อการคิดริเริ่มเชิงกลยุทธ์ ในการทดลองเกี่ยวกับเอชไอวีทั่วโลกINSIGHT Network:
- Copenhagen HIV Programme (CHIP) — Copenhagen, Denmark
- Medical Research Council (MRC) Clinical Trials Unit — London, United Kingdom
- National Centre in HIV Epidemiology and Clinical Research (NCHECR), University of New South Wales — Sydney, Australia
- The Institute for Clinical Research at the Veterans Affairs Medical Center — Washington, D.C., USA
แหล่งทุน : - สถาบันโรคภูมิแพ้และโรคติดเชื้อแห่งชาติ ประเทศสหรัฐอเมริกา (NIAID)
Funding agency
- National Institutes of Health (NIH)
- Agence Nationale de Recherches sur le SIDA et les Hépatites Virales (ANRS, France)
- Bundesministerium für Bildung und Forschung (BMBF, Germany)
- NEAT – European AIDS Treatment Network
- Australian National Health and Medical Research Council (NHMRC)
- Department of Bioethics, The Clinical Center, NIH
- Division of Clinical Research, NIAID, NIH
- National Cancer Institute (NCI), NIH
- National Heart, Lung, and Blood Institute (NHLBI), NIH
- National Institute of Mental Health (NIMH), NIH
- National Institute of Neurological Disorders and Stroke (NINDS), NIH
ผู้สนับสนุนยาต้านไวรัส:
- Abbott Laboratories, Inc.
- Bristol-Myers Squibb
- Gilead Sciences, Inc.
- GlaxoSmithKline, Inc.
- Merck & Co., Inc.
- Tibotec Pharmaceuticals, Ltd.
สถานที่ทำการวิจัย (รวมต่างประเทศ) : กว่า 50 หน่วยวิจัยทั่วโลก ทั้งทวีปอเมริกาเหนือ อเมริกาใต้ แอฟริกา ยุโรป
Study sites : ออสเตรเลีย และ เอเชีย (ประเทศไทยและอินเดีย)
สำหรับสถานวิจัยในประเทศไทยมี 9 หน่วยวิจัยดังนี้
- โรงพยาบาลจุฬาลงกรณ์ และ ฮีฟ-แนท ศูนย์วิจัยโรคเอดส์สภากาชาดไทย
- โรงพยาบาลศิริราช
- โรงพยาบาลศรีนครินทร์ จ.ขอนแก่น
- โรงพยาบาลชลบุรี
- โรงพยาบาลเชียงรายประชานุเคราะห์
- โรงพยาบาลสันป่าตอง จ.เชียงใหม่
- สถาบันบำราศนราดูร จ.นนทบุรี
- โรงพยาบาลรามาธิบดี
- สถาบันวิจัยวิทยาศาสตร์สุขภาพ มหาวิทยาลัยเชียงใหม่
ระยะเวลาเริ่มดำเนินงาน (เริ่ม intervention หรือ เริ่ม enroll อาสาสมัคร)
Study start
เริ่มปิดโครงการ : เปิดรับอาสาสมัครเข้าร่วมโครงการเดือนเมษายน 2009 และปิดรับ 23 ธันวาคม 2556
เป้าหมาย : ผู้ป่วยติดเชื้อเอชไอวีอายุ 18 ปีขึ้นไป ทั้งหมด 4,688 คน
รูปแบบของงานวิจัย
Study design
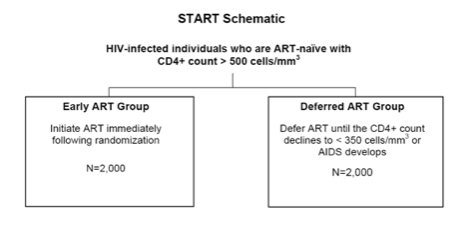
รูปแบบการศึกาวิจัยเป็น A multi-center, randomized trial การวิจัยแบบสุ่ม สหสถาบัน โครงการวิจัยหลักสตาร์ทจะทำการสุ่มผู้ป่วยติดเชื้อเอชไอวีผู้ใหญ่จำนวน 4,000 ราย ที่ไม่เคยกินยาต้านไวรัส และมีจำนวนCD4 >500 เซลล์/ไมโครลิตรอย่างน้อย 2 ครั้ง ภายใน 60 วัน ที่ผ่านเกณฑ์การเข้าร่วมโครงการให้ได้รับยาต้านไวรัสเชไอวีเลยทันที หรือรอจนกระทั่งจำนวนCD4
วัตถุประสงค์ของการวิจัย (วัตถุประสงค์หลัก รอง)
วัตถุประสงค์หลัก: เพื่อหาข้อสรุปว่ากลุ่มที่เริ่มการรักษาทันทีดีกว่ากลุ่มรอการรักษาหรือไม่ โดยประเมินจากการเจ็บป่วยจากโรคเอดส์ การเจ็บป่วยด้วยโรคที่ไม่เกี่ยวข้องกับเอดส์ หรือการเสียชีวิตไม่ว่ากรณีใดๆ
วัตถุประสงค์รอง:
ก. เพื่อเปรียบเทียบ ระหว่างกลุ่มที่เริ่มยาทันที กับกลุ่มที่รอเริ่มยา ในแต่ละจุดประเมินผลหลักดังนี้
- การป่วยเป็นเอดส์ หรือการเสียชีวิตด้วยสาเหตุจากโรคเอดส์
- การเจ็บป่วยด้วยโรคต่าง ๆ ที่ไม่เกี่ยวข้องกับโรคเอดส์ การเสียชีวิตที่ไม่ใช่จากโรคเอดส์
ข. เพื่อเปรียบเทียบ ระหว่างกลุ่มที่เริ่มยาทันที กับกลุ่มที่รอเริ่มยา ในแต่ละจุดประเมินผลรองดังนี้
- สาเหตุการตายทั้งหมด
- การเจ็บป่วยด้วยโรคต่าง ๆ ที่ไม่เกี่ยวข้องกับโรคเอดส์
- โรคที่เกี่ยวกับหลอดเลือดหัวใจ (CVD: myocardial infarction, stroke, coronary revascularization)
- การเกิดไตวายระยะสุดท้าย (ESRD: initiation of dialysis, renal transplantation)
- โรคตับวาย (Decompensateก liver disease)
- โรคมะเร็งที่ไม่เกี่ยวข้องกับโรคเอดส์ (Non-AIDS malignancy)ที่ไม่รวม basal and squamous cell skin cancers
- โรคมะเร็งที่ไม่เกี่ยวข้องกับโรคเอดส์ (Non-AIDS malignancy) ที่รวม basal and squamous cell skin cancers
- การเกิดโรคเอดส์ (AIDS)
- โรคปอดติดเชื้อ (Bacterial pneumonia)
- เหตุการณ์ไม่พึงประสงค์ต่าง ๆ (Adverse events)
- การเข้ารับการรักษาตัวในโรงพยาบาล (Hospitalization)
- คุณภาพชีวิตของอาสาสมัคร (Quality of life)
- การได้รับการดูแลจากบุคลากรทางการแพทย์และค่าใช้จ่าย (Health-care utilization and cost of care)
- พฤติกรรมเสี่ยงในการแพร่เชื้อเอชไอวีไปสู่ผู้อื่น (HIV transmission risk behavior)
- การเกิดเชื้อดื้อยา (HIV drug resistance)
- การเกิดภาวะเส้นเลือดที่ปอดอุดกั้น หรือเส้นเลือดดำอุดกั้น (Pulmonary embolism or deep vein thrombosis)
- การเกิดโรคเบาหวาน (New-onset diabetes mellitus)
- โรคหลอดเลือดหัวใจที่จำเป็นต้องรับประทานยารักษา (Coronary artery disease requiring drug treatment)
- โรคหัวใจเลือดคลั่ง (Congestive heart failure)
- โรคที่เกี่ยวข้องกับหลอดเลือดส่วนปลาย (Peripheral arterial disease)
- การทำงานของไตบกพร่อง (Change in estimated GFR and development of proteinuria)
- ภาวะความดันโลหิต และปริมาณไขมันในโลหิต (Blood pressure and blood lipids)
- คลื่นไฟฟ้าหัวใจผิดปกติ (ECG abnormalities)
- การใช้ยาลดความดันโลหิต หรือลดไขมันในโลหิต หรือการใช้ยาแอสไพริน
- การเกิดกระดูกหัก (Fractures)
ค. เพื่อเปรียบเทียบ ระหว่างกลุ่มที่เริ่มยาทันที กับกลุ่มที่รอเริ่มยา สำหรับจุดประเมินผลหลักและผลการรักษาที่สำคัญในกลุ่มย่อยโดยแบ่งตามลักษณะที่ประเมินไว้ตั้งแต่วันแรกที่เริ่มโครงการได้แก่
- อายุ
- เพศ
- เชื้อชาติ/สัญชาติ
- การมีอยู่ และระดับของปัจจัยความเสี่ยงสำหรับการเกิดภาวะร้ายแรงที่ไม่เกี่ยวข้องกับโรคเอดส์ เช่น การสูบบุหรี่, อัตราการกรอง
- ของไต, ภาวะการติดเชื้อไวรัสตับอักเสบร่วมด้วย, โรคเบาหวาน, ภาวะความเสี่ยงโรคหลอดเลือดหัวใจ, ไขมัน, ความดันโลหิต,
- คลื่นไฟฟ้าหัวใจผิดปกติ, อายุ และเพศ
- ค่า CD4 ตั้งต้น
- จำนวนเชื้อไวรัสเอชไอวีตั้งต้น
- ภูมิภาค
- วันที่เข้าร่วมโครงการ
- สูตรยาต้านไวรัสที่ได้รับ
วัตถุประสงค์อื่น ๆ:
ก. เพื่อเปรียบเทียบประสิทธิภาพระหว่าง 2 กลุ่มการรักษาเกี่ยวกับ
- การรับประทานยาต้านไวรัสตลอดระยะเวลาที่เข้าร่วมโครงการ
- จำนวนเชื้อไวรัสเอชไอวีตลอดระยะเวลาที่เข้าร่วมโครงการ
- ปริมาณ CD4 ตลอดระยะเวลาที่เข้าร่วมโครงการ
ข. เพื่ออธิบายเกี่ยวกับประเด็นต่อไปนี้
- สูตรยาต้านไวรัสเริ่มแรก
- จำนวนเชื้อไวรัสเอชไอวี และปริมาณ CD4 ที่ตอบสนองต่อสูตรยาต้านไวรัสแรก
- จำนวนครั้งที่เปลี่ยนสูตรยาต้านไวรัสตลอดระยะเวลาที่เข้าร่วมโครงการ และในปีแรกที่ได้รับการรักษา
- การรักษาที่ไม่เป็นไปตามแผนการรักษา (เช่น การหยุดยาต้านไวรัสในกลุ่มที่เริ่มการรักษาทันที หรือการเริ่มยาต้านไวรัสก่อนกำหนดในกลุ่มรอการรักษา)
ค. เพื่อประเมินอัตราส่วน CD4 ที่ลดลงมาจนถึงระดับต่ำกว่า 350 ตัว/ม.ม.³ ประเมินอัตราส่วนของอาสาสมัครที่มีภาวะเจ็บป่วยที่ต้องเริ่มการรักษาด้วยยาต้านไวรัส ประเมินระยะเวลาในการเริ่มยาต้านไวรัส และประเมินอัตราส่วนของอาสาสมัครที่ต้องเริ่มยาต้านไวรัสก่อนที่ CD4 จะลดลงต่ำกว่า 350 ตัว/ม.ม.³ ในกลุ่มรอการรักษ
ง. ศึกษาตัวบ่งชี้ในการเกิดโรคเอดส์และโรคที่ไม่เกี่ยวข้องกับโรคเอดส์ในทั้ง 2 กลุ่มการรักษา
จ. ประเมินความชุกและระดับของปัจจัยความเสี่ยงเริ่มแรกในการเกิดโรคที่ไม่เกี่ยวข้องกับโรคเอดส์ เช่น การสูบบุหรี่, อัตราการกรองของไต, ภาวะการติดเชื้อไวรัสตับอักเสบร่วมด้วย, โรคเบาหวาน, ภาวะความเสี่ยงโรคหลอดเลือดหัวใจ, ไขมันในเลือด, ความดันโลหิต, คลื่นไฟฟ้าหัวใจผิดปกติ, อายุ และเพศ
ฉ. ศึกษากระบวนการการให้ความยินยอมเข้าร่วมโครงการโดยเปรียบเทียบระหว่างหนังสือให้ข้อมูลฉบับสมบูรณ์กับฉบับย่อ
ความสำคัญ
Significance
N/A
ความก้าวหน้า ณ ปัจจุบัน ปิดรับอาสาสมัครเรียบร้อยแล้ว ขณะนี้อยู่ในระหว่างการติดดามอาสามัคร คาดว่าจะเสร็จสิ้น Progression โครงการประมาณ ธันวาคม 2559
ผลการศึกษาที่น่าสนใจ
Interesting findings
N/A
เอกสารที่ต้องการเผยแพร่ (ถ้ามี)
Publications
N/A
เชื่อมโยงไปยัง web site ของโครงการ (ถ้ามี)
Link to project’s web site
https://clinicaltrials.gov/ct2/show/NCT00867048
http://insight.ccbr.umn.edu/




